“愈见例量”|含注射用左亚叶酸/5-FU同输疗法使初始不可切除的直肠恶性肿瘤伴肝多发转移患者获得手术机会!
前言
肝转移是结直肠癌患者主要的死亡原因之一。未经治疗的肝转移患者的中位生存期(OS)仅6.9个月,无法切除患者的5年生存率低;而若肝转移灶能完全切除(或达到无疾病证据状态),患者的中位OS则明显延长1。本文详细介绍了一例初始不可切除的直肠恶性肿瘤伴肝多发转移患者,采用含左亚叶酸/5-FU同时输注的联合治疗手段,由不可切除转化为可切除,期待为临床实践带来启迪。
患者病例
基本情况
患者女性,60岁
主诉:大便次数增多6个月余
现病史:2023年1月因“大便次数增多伴便血”外院就诊。有排气排便,3个月体重下降约15kg。外院腹部CT和肠镜示:直肠恶性肿瘤待排,伴肝多发转移。
既往史:既往有高血压病史数十年,血压最高160/90mmHg,口服氨氯地平5mg po qd血压控制可,否认其他慢性疾病。
家族史:其父82岁患胃癌,其弟54岁患肺癌,死于肺癌。
基线检查
肿瘤指标:癌胚抗原(CEA) 2082 ng/ml,余肿瘤指标正常范围。
肠镜:据肛缘8cm,绕肠1周占位,肠镜勉强通过,病理:腺癌,中分化,II级。
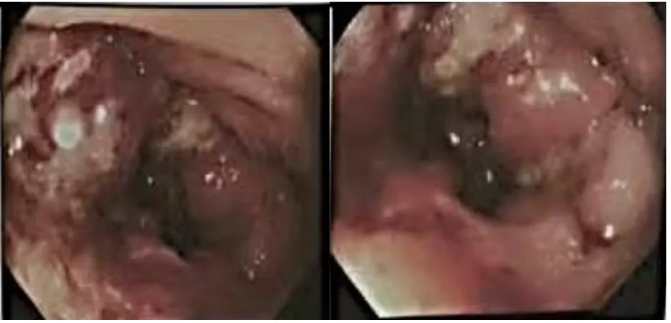
图1 肠镜检查
直肠磁共振:直肠恶性肿瘤(T3N2Mx),MRF(+), EMVI(-)。
上下腹增强CT:直肠占位,考虑直肠癌,肝脏多发转移瘤。
肺部CT:未见明显转移灶。
上腹部增强MRI:肝脏多发边缘强化的转移瘤(大于10枚),最大直径约为40mm。
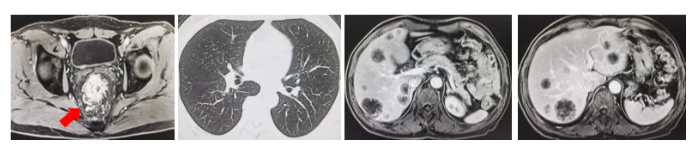
图2 影像学检查
免疫组化:Claudin18.2(-),TROP2(20%+),HER2(0),Ki67(70%+),P53(+90%),PD-L1(CPS:10),MLH1(+),PMS2(+),MSH2(+),MSH6(+)(错配修复基因完整)。
微卫星不稳定性检查:微卫星稳定,NR21(-),Bat26(-),NR27(-),Bat25(-),NR24(-),Mono27(-)。
基因检测:K-ras 未突变、 N-ras未突变、PIK3CA未突变、BRAF V600E未突变。
临床诊断
1.直肠恶性肿瘤伴肝多发转移(cT4N2M1),初始不可切除
2.不完全性肠梗阻
3.轻度贫血
4.高血压病2级(高危)
治疗经过
第1次MDT讨论
直肠癌肝多发转移,原发灶无梗阻、穿孔症状,初始不可切除;肝功能 Child-Pugh A 级,无肝外转移;肿瘤学评价:临床风险评分 4 分;ECOG 评分 0 级,治疗愿望强烈。治疗方案:FOLFIRINOX+西妥昔单抗,转化治疗。
2023-2-10至2023-4-10予FOLFOXIRI+西妥昔单抗方案化疗4个周期(西妥昔单抗700mg静滴 d1+ 奥沙利铂140mg静滴 d1+氟尿嘧啶0.6静注+ 左亚叶酸钠300mg,氟尿嘧啶4.0mg 维持46-48H Q2w)。
毒副反应:骨髓抑制II级,腹泻 II级。
第2次MDT
●肿瘤指标:CEA 6.67 ng/ml。
●上腹部磁共振:肝脏多发转移灶较强缩小,较大2枚位于肝右后叶包膜下(24*16.5mm,20.5*18mm)。
●直肠磁共振:直肠癌(T2),肿瘤和周围淋巴结较前缩小。
●肺部CT:未见明显占位性病变。
MDT结论:肝转移灶由初始不可切除,转化为可切除,拟外科手术根治。
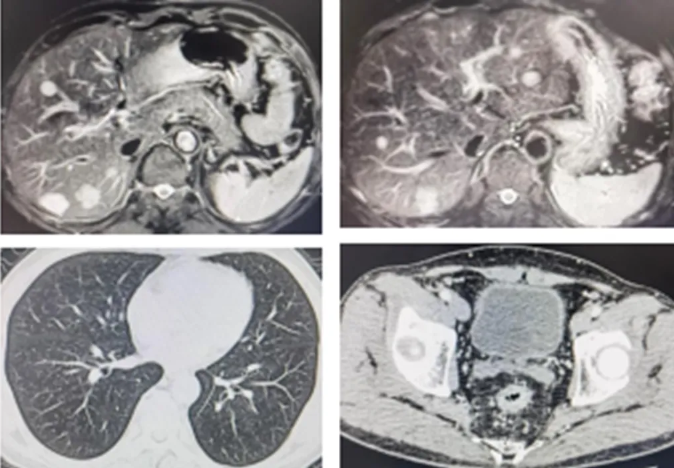
图3 影像学检查
2023年4月24日,肝部分切除术。
●术中情况:肝脏质软,肝硬化无,腹水无,脾脏无肿大,肝内多发肿瘤,较大者约3*4cm,无包膜,无侵犯血管。
●术后病理:肝肿瘤转移性腺癌,间质大片纤维化,纤维化区域占肿瘤区域大于75%,符合治疗反应;切缘阴性。
●术后第7天正常出院。
休息3周后,2023年5月20日至2023年6月22日给予FOLFOXIRI+西妥昔单抗方案化疗2个周期。
2023年6月23日,腹腔镜辅助直肠癌根治术。
●术中情况:上腹部呈粘连状态,肿瘤位于距肛缘7cm,直径约3*4cm,纤维疤痕化疗后改变,未突破纤维外层,肠系膜可见肿瘤淋巴结,血管根部未见肿大淋巴结,探查腹腔内余脏器未见明显转移灶(保留LCA)。
●术后病理:“直肠”腺癌II级,(浸润型,2*1.5*0.7cm),侵至外膜,脉管内见癌栓,神经束见侵犯,肿瘤出芽:中级别;间质纤维组织增生,肿瘤减少<50%,TRG分级:3级;肿瘤平面肠壁淋巴结(3/8)见癌转移;“上下切缘”、剥离面、“第253组淋巴结”(脂肪组织)均阴性。
●术后恢复情况:术后第7天出现吻合口漏(B级),充分引流,加强抗感染,营养支持;麻痹性肠梗阻好转,流质饮食;术后3周正常出院。
出院1个月门诊随访:
●肿瘤指标:CEA 139 ng/ml
●上腹部磁共振:肝内多发异常强化结节灶,考虑转移瘤,大部分呈治疗后改变,部分仍存在肿瘤活性,较前MR增强病灶较前缩小。
第3次MDT讨论
2023年8月开始继续化疗:FOLFOXIRI+西妥昔单抗方案(2周方案),6个疗程结束后再次复查肿瘤指标:CEA 11.8 ng/ml。
2023年12月,肝肿瘤微波射频消融:术中见肝右叶V段1枚,大小约1*1.2cm,VIII段1枚,大小约1*1cm,另见肝右叶可疑2枚结节。
2024年1月-2024年3月口服卡培他滨+西妥昔单抗,维持治疗4个疗程。
术后9个月随访(2024年4月):
●肿瘤指标:CEA 174 ng/ml,余肿瘤指标正常范围。
●上腹部磁共振:肝内多发异常强化结节灶,考虑转移瘤,较前片增多增大,较大直径约40mm。
●肺部CT:两肺多发小斑点及小结节,部分伴空洞形成,较前增多增大,考虑转移可能。
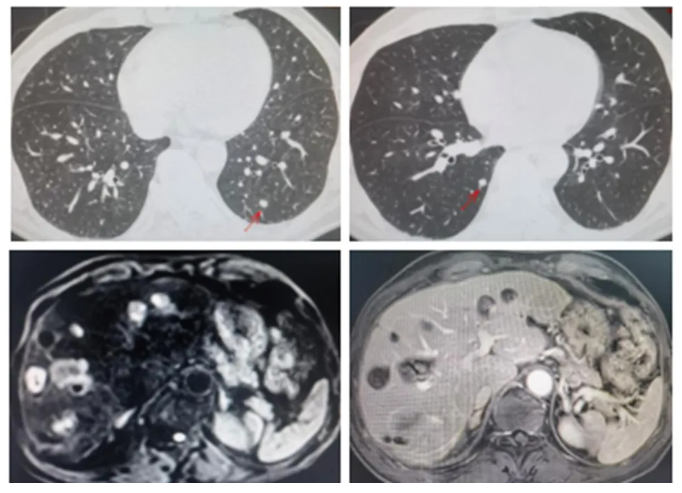
图4 影像学检查
第4次MDT讨论(肝转移灶切除术后11个月,直肠原发灶切除术后9个月)
●影像科:评估肝转移灶和肺转移灶的数量和位置
●肝脏外科:肝脏再次出现转移灶,不可切除
●介入科:肺部新发多发转移灶,不可切除
●肿瘤科:直肠癌肝转移切除术后转移,建议二线全身化疗
二线治疗方案:
2024年4月-2024年7月,奥沙利铂120mg静滴 d1+氟尿嘧啶0.6静注+左亚叶酸钠300mg与氟尿嘧啶3.0mg 维持46-48H Q2w(共6个疗程,最后1个疗程未加贝伐珠单抗)。
2024年7月,行肝肿瘤微波消融术。
2024年7月,腹部MR:肝脏部分切除+介入治疗后改变,肝内多发低密度影,部分为凝固坏死灶可能,部分病灶内密度增高。肺部CT:两肺多发小斑点及小结节较前相仿。
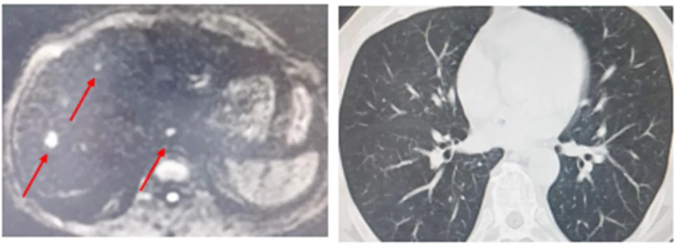
图5 影像学检查
毒副反应:骨髓抑制III级,腹泻 II级,白介素-11升血小板等对症处理,骨髓抑制缓解。
二线维持治疗方案:
2024年7月,二线贝伐珠单抗联合卡培他滨维持治疗,具体方案:贝伐珠单抗 400mg d1+ 卡培他滨 1.5g bid po d1-14,Q21d(共2个疗程)。
●肿瘤指标:CEA 134.5 ng/ml。
●上腹部MR:肝脏多发转移瘤,较前片增多增大。
●肺CT:两肺多发小斑点及小结节,部分伴空洞形成,较前片增多增大。
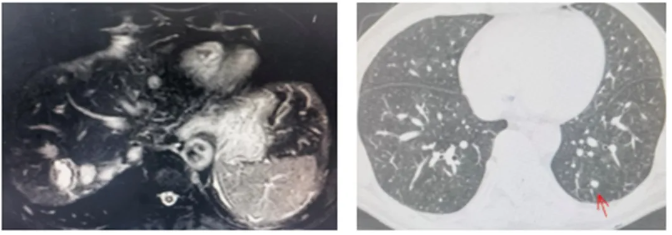
图6 影像学检查
三线治疗方案(第5次MDT讨论):
2024年9月开始,普特利单抗200mg d1,Q21d + 呋喹替尼 3mg po qd d1-21 + TAS-102 40mg bid po d1-5,d8-12,Q28d,共2个疗程,疾病进展(PD)
●肿瘤指标:CEA 194.2 ng/ml。
●上腹部MR: 肝脏多发转移瘤,较前片增多增大。
●肺CT: 两肺多发结节考虑转移瘤,较前片增多增大。
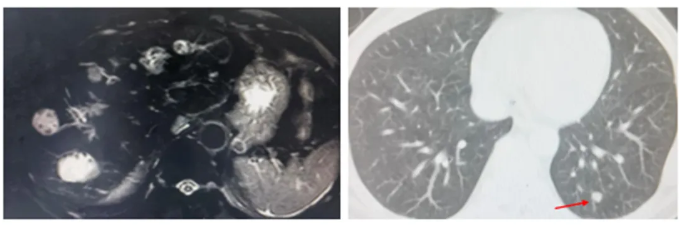
图7 影像学检查
四线治疗方案(第6次MDT讨论):
2024年11月开始予普特利单抗 200mg d1+贝伐珠单抗400mg d1+ 西妥昔单抗800mg d1+ 奥沙利铂180mg d1+卡培他滨 1g p.o. bid d1-14,Q21d
目前已进行2个疗程,疗效评价:疾病稳定(SD)。
●肿瘤指标:CEA 182.5 ng/ml。
●上腹部MR:肝脏多发转移瘤,较前片增多增大,部分存在肿瘤活性,部分呈治疗后改变。
●肺CT:两肺多发结节考虑转移瘤,较前片大致相仿。
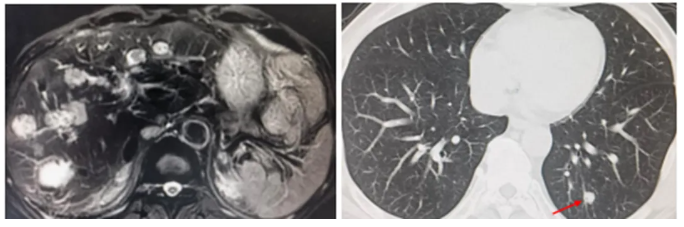
图8 影像学检查
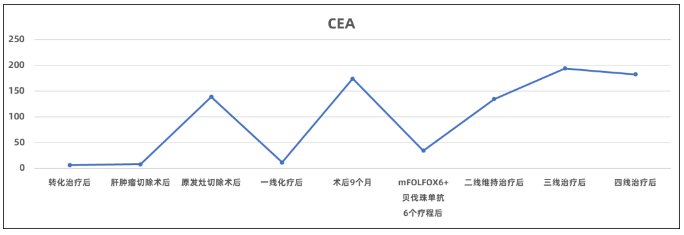
图9 肿瘤标志物变化
病例小结
本例为直肠恶性肿瘤伴肝多发转移(cT4N2M1)患者,经评估初始不可切除。2023年2月10日至2023年4月10日行FOLFOXIRI(含注射用左亚叶酸/5-FU同输疗法)+西妥昔单抗,4个周期后,由不可切除转化为可切除。2023年4月24日,行肝部分切除术。2023年5月20日至2023年6月22日行FOLFOXIRI+西妥昔单抗方案化疗2个周期。2023年6月,行直肠癌根治术。2023年8月开始,予FOLFOXIRI+靶向治疗6个疗程,2023年12月肝肿瘤射频消融,疗效评价SD。2024年1月-2024年3月口服卡培他滨+西妥昔单抗维持治疗4个疗程。疾病进展后,2024年4月至7月,接受二线治疗(mFOLFOX6+贝伐珠单抗,6个疗程),以及卡培他滨+贝伐珠单抗维持治疗,2个疗程。2024年9月-10月,三线治疗予免疫治疗+呋喹替尼+TAS-102,2个疗程,疾病再次进展,2024年11月至12月四线治疗采用抗EGFR靶向治疗+Xelox,2个疗程,疗效评价SD,目前患者仍在治疗中。
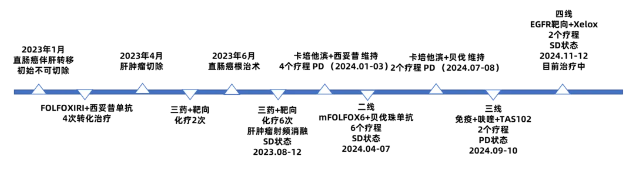
图10 患者治疗过程
总结与反思
肝脏是结直肠癌血行转移主要的靶器官,结直肠癌肝转移是结直肠癌治疗的重点和难点之一1。本例患者经诊断为直肠恶性肿瘤伴肝多发转移(cT4N2M1),初始不可切除。遂采用FOLFIRINOX(含注射用左亚叶酸/5-FU同输疗法)+西妥昔单抗进行转化治疗,以期将患者由不可切除转化为可切除。
众所周知,注射用左亚叶酸钠仅含左旋活性成分,剔除右旋干扰成分,其为钠盐制剂,溶解性好,克服了钙盐制剂中过多无治疗作用的钙离子对心脏等产生的副作用,使5-FU/LV同时输注成为可能,缩短了患者输注时间2h,实现了 “同时输注、简化步骤、全程增效”。临床研究表明,与左亚叶酸序贯给药相比,左亚叶酸/5-FU同时持续输注可以显著延长患者中位无进展生存期(PFS)7.5个月,降低疾病进展风险50%;延长中位总生存期(OS)4.3个月,降低死亡风险40%,且未增加安全性风险2。本例患者采用FOLFIRINOX(含注射用左亚叶酸/5-FU同输疗法)+西妥昔单抗治疗后,肝转移灶由初始不可切除转化为可切除。
值得一提的是,有关结直肠癌肝转移(CRLM)同期手术还是分期手术的问题,通常来讲,对转移灶切除≤2个肝段的CRLM患者,同期手术可以缩短患者住院周期,节省治疗费用,减轻患者精神压力。对于大范围肝段切除或者高龄、全身条件较差的CRLM患者建议行分期手术。另外,“肝脏优先”策略可以降低伤口感染、肝功能衰竭等并发症,同时也有助于降低术后再次发生肝转移的风险。如果肿瘤原发灶出现梗阻、穿孔、出血等需要急诊手术来控制病情时,应该优先处理原发灶,放置肠梗阻支架、原发灶切除或者近端结肠造口等方式。
本例患者转化成功后,采用了肝部分切除术、直肠癌根治术、FOLFOXIRI+靶向治疗、卡培他滨+西妥昔单抗等多种方案治疗。最近一次随访时,患者疗效评价为SD,目前患者仍在治疗中。再次印证了含注射用左亚叶酸/5-FU同输疗法有助于患者临床获益。
专家简介

- 骆洋医生 -
上海交通大学医学院附属仁济医院 胃肠外科
中国医药教育协会直肠癌保肛外科专委会委员
上海市抗癌协会胃肠肿瘤腹腔镜专委会并发症防治学组秘书
上海抗癌协会会员
《中国普通外科杂志》中青年编委
主持国家自然科学基金青年项目1项
获得实用新型专利2项,副主编专著2部
参考文献:
1. 中国医师协会外科医师分会, 中华医学会外科分会胃肠外科学组, 中华医学会外科分会结直肠外科学组, 等.中华胃肠外科杂志, 2023, 26(1): 1-15.
2. Romano FJ, et al.Folinic acid in colorectal cancer: esquire or fellow knight? Real-world results from a mono institutional, retrospective study.Oncotarget . 2021 Feb 2;12(3):221-229.
(转载自医脉通)

免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。












